HERPES SIMPLEX TIPOS 1 e 2 PCR [cód. 11070]
NOME DO EXAME
HSV-1 e HSV-2, detecção, PCR
OUTROS NOMES DO EXAME
Herpes genital por PCR; Herpes simplex, tipos 1 e 2, detecção por PCR; Herpes simplex, 1 e 2, detecção por PCR; HSV, tipos 1 e 2, PCR qualitativo; HSV, 1 e 2, PCR qualitativo; HSV, tipos 1 e 2, DNA por PCR; HSV, 1 e 2, DNA por PCR; PCR qualitativo para Herpes simplex tipos 1 e 2; PCR qualitativo para vírus Herpes simples 1 e 2; PCR para HSV1 e 2; Teste molecular para HSV 1 e 2; Teste molecular para vírus Herpes simples 1 e 2, Detecção de vírus Herpes simples 1 e 2
DESCRIÇÃO
Herpesvírus compreende uma grande família de vírus dos quais oito infectam apenas humanos. São eles: vírus herpes simplex tipos 1 (HSV1) e 2 (HSV2), vírus varicela-zoster (VZV/HHV-3), citomegalovírus (CMV/HHV-5), vírus Epstein-Barr (EBV/HHV-4), herpesvírus humano 6 (HHV-6), herpesvírus humano 7 (HHV-7) e vírus do sarcoma de Kaposi (KSHV/HHV-8). Todos estes herpesvírus podem estabelecer infecções latentes em tecidos específicos que são características para cada vírus. Destes vírus, HSV1 e HSV2 causam infecções crônicas dos órgãos genitais caracterizadas por sintomas que incluem bolhas ou feridas na área genital, ardência ou formigamento na área genital, dor ao urinar e corrimento vaginal incomum.
HSV1 e HSV2 causam infecções sexualmente transmissíveis (IST) muito frequentes e são conhecidas como herpes genital. De acordo com Organização Mundial da Saúde (OMS), estima-se que em todo o mundo cerca de 846 milhões de pessoas com idades entre 15 e 49 anos estejam vivendo com infecções de herpes genital e que pelo menos 1 pessoa a cada segundo adquira uma nova infecção de herpes genital. Os fatores de risco para infecção por herpes genital incluem:
• Número de parceiros sexuais. Quanto mais parceiros sexuais, maior a probabilidade de contrair infecção por herpes genital.
• Sexo sem proteção. Não usar ou usar de forma incorreta o preservativo.
• Idade. As infecções são mais frequentes em pessoas de 15 a 24 anos.
• Sexo sem proteção. Não usar ou usar de forma incorreta o preservativo.
• Histórico de IST. Indivíduos com histórico de IST apresentam maior probabilidade de infecção por herpes genital.
• Sexo atribuído no nascimento. Mulheres correm maior risco de contrair herpes genital.
• Infecção por HIV. Pacientes HIV+ ou portadores de outra condição que enfraqueça o sistema imunológico correm maior risco de infecção
• Parceiro com herpes genital. Ter um parceiro com herpes genital que não toma os remédios adequadamente.
A maioria das pessoas com herpes genital não apresenta lesões e somente percebe que têm herpes genital após a detecção de anticorpos anti-HSV1 ou anti-HSV2 no exame de sangue. Contudo, estas pessoas assintomáticas ainda podem transmitir a herpes genital. Por este motivo, é importante a pesquisa do herpes genital para identificar portadores assintomáticos e, desta forma, monitorá-los. Metodologias moleculares como PCR e qPCR podem ser usadas para detecção de herpes genital mesmo em pacientes assintomáticos. Estas metodologias permitem identificar com rapidez e precisão o tipo de HSV responsável pela infecção.
UTILIDADE DO EXAME
Este teste deve ser solicitado pelo médico e visa:
• Confirmar uma infecção ativa de herpes
• Determinar o tipo de herpes (HSV-1 ou HSV-2)
• Diagnosticar herpes genital em pacientes sintomáticos
• Auxiliar na triagem de mulheres com resultados anormais de Papanicolau.
• Permitir o monitoramento clínico e gerenciamento de pacientes.
NECESSIDADE DE PEDIDO MÉDICO
O pedido médico deve ser enviado juntamente com a amostra.
COBERTURA OPERADORA PLANO DE SAÚDE
Não. O Código TUSS deste exame é 40314375 – Herpes vírus humano 1,2 por PCR.
NECESSIDADE DE CONSENTIMENTO
Não.
PREPARAÇÃO DA PACIENTE
Alguns cuidados são necessários a fim de garantir a qualidade deste exame. Estes cuidados incluem não utilizar creme e/ou óvulo vaginal; não utilizar ducha ou fazer lavagem interna; não realizar exame ginecológico com toque e/ou ultrassonografia transvaginal; não manter relações sexuais, com ou sem uso de preservativos. De preferência, não realizar este exame durante a menstruação.
AMOSTRA
Secreção cérvico-vaginal (Preferível) (outras amostras, contatar a Genoa/LPCM).
INSTRUÇÕES DE COLETA E ARMAZENAMENTO DA AMOSTRA
A Genoa/LPCM fornece o “kit de coleta” necessário para a coleta da amostra cérvico-vaginal. Este kit contém:
• Frasco com líquido conservante1
• Escovinha cervical
• Espátula
• Espéculo siliconado2
• Envelope/pedido médico
A coleta da secreção cérvico-vaginal deve ser realizada durante o exame ginecológico em um ambiente de assistência médica. Este kit não deve ser utilizado para autocoleta.
Procedimentos anterior à coleta:
• Abrir um kit fornecido e remover todos os itens contidos no mesmo.
• Preencher o envelope/pedido médico com as informações solicitadas. Não esquecer de assinar e carimbar o pedido médico.
• Remover uma das etiquetas contidas no envelope/pedido preenchido e fixar no frasco com líquido conservante. O código contido na etiqueta é idêntico ao impresso no envelope/pedido.
Coleta da amostra:
• Remover a tampa do frasco cuidadosamente para evitar derramamento do líquido.
• Colher a amostra da secreção cérvico-vaginal com auxílio da escovinha cervical e espátula siliconada.
• Inserir a escovinha no líquido conservante e lavá-la sob vigorosa agitação mecânica a fim de liberar as células.
• Remover a escovinha do frasco e a descartar.
• Fechar firmemente o frasco a fim de evitar vazamento.
• Colocar o frasco dentro de envelope/pedido. Para fechar o envelope, basta retirar a fita protetora da cola e dobrar a aba até que entre em contato com o envelope.
O envelope contendo o frasco deve ser armazenado a temperatura ambiente até a sua retirada ou o seu envio.
(1) A solução conservante contém metanol em sua formulação. Evite contado com os olhos e/ou pele.
(2) A adição de outros lubrificantes deve ser evitada visto que pode interferir nas reações enzimáticas necessárias para a amplificação dos fragmentos de DNA de interesse.
ESTABILIDADE DA AMOSTRA
As células colhidas e armazenadas no líquido conservante são estáveis à temperatura ambiente por até 42 dias.
VOLUME MÍNIMO DA AMOSTRA
O frasco fornecido contém 18 ml de solução conservante e pode ser utilizado para análise citológica e pesquisa de agentes infecciosos, incluindo HPV.
RETENÇÃO DA AMOSTRA
O tempo de retenção da amostra pelo laboratório é de 90 dias.
Aliquotagem de amostras para exames moleculares
Alíquota refere-se a uma parte ou porção representativa de uma amostra maior, que é separada para ser utilizada em outro experimento.
Para que nenhuma informação seja perdida nesse processo, o laboratório deve manter um controle de alíquotas e, em um primeiro momento, o técnico identifica o microtubo que receberá a alíquota e, ao mesmo tempo, a registra no sistema. A alíquota deve ser realizada por um técnico de laboratório familiarizado com os objetivos e os resultados esperados.
O exemplo de aliquotagem será do líquido de Citologia de Base Líquida (CBL). A CBL, também conhecida como citologia oncótica em meio líquido ou citologia em meio líquido, é uma técnica onde, ao invés de raspagens na lâmina, as células são coletadas e suspensas em um líquido preservante com metanol, que é tóxico, requerendo uso de luvas.
O líquido da CBL pode conter células livres, debris, células inflamatórias, hemácias, bactérias, vírus, fungos, protozoários, DNA livre, espermatozoides, fibrina, resíduos de cremes, outras substâncias usadas na lavagem vaginal, e mais. Essas partículas estão parcialmente livres no líquido ou sedimentadas no fundo, e o exame de Patologia Molecular busca extrair todo o DNA e RNA presentes na amostra.
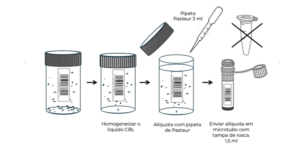
O técnico deve homogeneizar a amostra para que tudo seja representado, submetendo-a a forte agitação motora. Em seguida, transferir 1,5 ml desse líquido usando uma pipeta de Pasteur para o microtubo e descartá-lo. Usar um microtubo com tampa de rosca (Kasvi é recomendado) e nunca um microtubo de fechamento por pressão, pois este pode abrir espontaneamente no traslado ao laboratório. Lembre-se: se aliquotar mais do que o necessário (CBL originalmente contém 18 ml de preservante), pode-se interferir no processamento automático da citologia por pouco líquido. Nestes casos, o técnico deverá repor o volume com líquido preservante ou, na falta deste, com álcool 70%.
Medidas para aliquotagem abaixo. Dica: se enviar ≥ 4 ml, utilize um tubo Falcon (ou similar) de 15 ml, como na figura ao lado.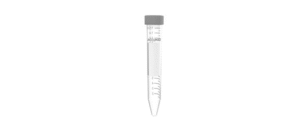 PCR para HPV – 2 ml
PCR para HPV – 2 ml
PCR para Painel Ginecológico – 2 ml
PCR para HPV e Painel Ginecológico – 2 ml
Captura Hibrida HPV – 4 ml
Captura para HPV + PCR para HPV – 6 ml
Captura para HPV + PCR para painel ginecológico – 6 ml
Captura para HPV + PCR para HPV e painel ginecológico – 6 ml.
DESCRIÇÃO DA METODOLOGIA
O DNA do Herpesvírus é detectado por PCR utilizando primers específicos para HSV1 e HSV2. Primers adicionais tendo como alvo fragmentos de DNA humanos são adicionados como um controle interno para monitorar todo o processo de preparação da amostra e amplificação por PCR.
ESPECIFICIDADE
Os fragmentos de DNA amplificados pelos pares de primers utilizados foram sequenciados e as sequências nucleotídicas comparadas com as sequências referências de HSV1 e HSV2. Todas as sequências obtidas confirmaram os resultados esperados. Logo, as especificidades foram de 100% para os dois pares de primers utilizados.
SENSIBILIDADE
A sensibilidade de cada par de primer é elevada (>95%).
RESULTADO E INTERPRETAÇÃO
O resultado é apresentado de forma simples e objetiva, a fim de facilitar sua compreensão. Contudo, a interpretação deste resultado é um ato médico e deve ser realizada levando-se em consideração os dados clínicos e demais exames do paciente.
Os três resultados possíveis e suas interpretações estão apresentados a seguir.
• DETECTADO3. Este resultado indica que HSV1 e/ou HSV2 foram detectados na amostra analisada.
• NÃO DETECTADO3. Este resultado indica que HSV1 e HSV2 está ausente ou abaixo dos limites de deteção dos métodos na amostra analisada.
• CELULARIDADE ABAIXO DO DETECTÁVEL. Este resultado indica que não é possível obter DNA com a qualidade e/ou em quantidade necessárias para a realização do exame. Alternativamente, inibidores de reação (por exemplo, lubrificantes) podem estar presentes e interferi nas reações enzimática, impedindo a realização do exame.
(3) Para um diagnóstico mais preciso de herpes genital, recomendamos a análise citológica (Citologia em Base Líquida) que deve ser realizada no mesmo espécime utilizado para o exame de Herpes Simplex tipos 1 e 2 por PCR.
DISPONIBILIDADE DO LAUDO (TAT)
O laudo estará disponível 3 a 5 dias úteis após a autorização do exame.
VALORES DE REFERÊNCIA
O valor de referência para este exame é NÃO DETECTADO.
PRECAUÇÕES
Fatores como coleta inadequada da amostra, tipo de amostra biológica, tempo decorrido entre a coleta e o início dos sintomas e oscilação da quantidade do vírus podem influenciar no resultado do exame. Variações nas sequências dos DNA dos agentes infecciosos onde se anelam os primers podem gerar resultados falso-negativos. Havendo discordância entre o resultado do teste e o quadro clínico do paciente, aconselha-se que o exame seja repetido em outra amostra.
NOTAS
Este exame é desenvolvido e validado nos laboratórios da Genoa/LPCM.
OBSERVAÇÕES
A Encondexa está comprometida em manter a confidencialidade das informações dos pacientes. Volume Mínimo (quantidade de espécime necessária para realizar um ensaio uma vez.
Recepção do volume mínimo torna impossível repetir o teste ou realizar testes de confirmação. Em algumas situações, um volume mínimo do espécime pode resultar em quantidade não suficiente, exigindo que um segundo espécime seja coletado).
Informe se o caso envolve “Resultados Semi-Urgentes” definidos como resultados relacionados a doenças infecciosas prontamente necessários para evitar consequências de saúde potencialmente sérias para o paciente.
Teste URGENTE: em raras circunstâncias, o teste URGENTE do laboratório de referência pode ser necessário para pacientes que precisam de tratamento imediato. Para agendar o teste URGENTE, peça ao patologista, médico ou gestor de laboratório ou Representante para ligar para a Encodexa™ e uma vez acordado que há necessidade da categoria de teste URGENTE, serão feitos arranjos para atribuir recursos para executar o teste em uma base URGENTE quando a amostra for recebida.
A Encodexa™ usa no mínimo dois identificadores específicos do paciente para verificar se o paciente correto é correspondido com o espécime correto e o pedido correto para serviços de teste. Conforme um espécime é recebido na ENCODEXA, o nome e sobrenome do paciente, data de nascimento, número do prontuário médico e número de acesso do cliente são verificados comparando os rótulos no tubo ou recipiente do espécime com o pedido eletrônico e qualquer papelada (folha de lote ou formulário) que possa acompanhar o espécime a ser testado. Quando discrepâncias são identificadas, o Centro de Atendimento de Consultas da Encondexa telefonará para o cliente para verificar as informações discrepantes para garantir que a Encodexa™ esteja realizando o teste correto para o paciente correto. Os espécimes são considerados rotulados incorretamente quando há uma incompatibilidade entre os identificadores específicos da pessoa no espécime e as informações que acompanham o espécime. Quando identificação insuficiente ou inconsistente for enviada, a Encodexa™ recomendará que um novo espécime seja obtido.
Prazo dos exames (TAT) O extenso menu de testes do Encodexa™ reflete as necessidades de nossa própria prática de assistência médica. Estamos comprometidos em fornecer o TAT mais rápido possível para melhorar o diagnóstico e o tratamento. Consideramos os serviços laboratoriais como parte do continuum de atendimento ao paciente, em que as necessidades do paciente são primordiais. Nesse contexto, nos esforçamos para cumprir nossas obrigações de serviço. Nosso histórico de serviço e nossas métricas de qualidade documentarão nossa capacidade de entregar em todas as áreas de serviço, incluindo TAT. A Encodexa™ define TAT como o tempo de teste analítico (o tempo do qual uma amostra é recebida no local de teste até o momento do resultado) necessário e é listado para cada teste como “Relatório disponível”. O TAT é monitorado continuamente por cada local de laboratório em execução dentro da Encodexa™.

Genoa e Encodexa são duas marcas LPCM
